|
回医烙灸对兔膝骨性关节炎基质金属蛋白酶及其抑制剂表达影响的研究
膝关节是人类负重主要关节之一, 一些危险因素[1]包括年龄、超重、股四头肌薄弱、性别、家族史、过度运动等使膝骨性关节炎 (Knee osteoarthirtis, KOA) 的发病率居高不下, 据最新的KOA流行病学调查[2], 我国KOA的患病率为8.1%, 提示KOA患者约有1.1亿。其软骨和骨的病理改变引起关节疼痛、僵硬和不同程度的功能障碍是其主要临床表现, 针对KOA的发病机制目前尚不完全清晰[3], 但越来越多的证据表明, 软骨细胞外基质过度降解在KOA的发病中扮演重要角色, 最终可导致软骨损伤、破坏[4,5]。软骨细胞外基质 (extracellular matrix, ECM) 主要成分为胶原和蛋白多糖, 二者相互作用, 胶原质纤维提供软骨张力能力及抗压力作用, 结合蛋白多糖的吸水性维持软骨弹性[6]。基质金属蛋白酶可降解细胞外基质, 破坏胶原纤维网结构, 胶原纤维溶解使软骨细胞失去保护, 且附着其结构网上的蛋白聚糖渗透性增加导致组织肿胀压力增高, 综合因素导致软骨病理损害的恶性循环促进KOA进展[7]。而基质金属蛋白酶抑制因子能抑制胶原降解, 维持胶原纤维网结构稳定, 提高软骨保护作用[8]。有研究表明, 基质金属蛋白酶在KOA表达异常, 打破与蛋白酶组抑制剂平衡从而导致ECM过度降解, 引起软骨退变[9]。
烙灸疗法是具有鲜明地方特色的治疗方法, 是传统医学的一部分, 具有“补肾通络、强筋健骨”的作用[10], 团队前期研究发现烙灸疗法可减少KOA软骨细胞凋亡、延缓KOA进展[11], 本研究在此基础上进一步探讨烙灸对兔KOA模型软骨细胞外基质MMP2、MMP3、和TIMP-1表达的影响。
1 实验材料
1.1 实验动物
30只成年健康新西兰兔由宁夏医科大学动物实验中心提供, 雌雄不限, 体质量2.5~3.0 kg, 维持饲养环境一定的温度和湿度, 单笼饲养, 12 h昼夜循环, 不中断水和食物供应, 适应性饲养5天后, 第6天开始造模。
1.2 主要仪器、试剂和药品
显微镜、凝胶成像系统、ABI7900 Q-PCR仪器 (由宁夏医科大学基础医学实验室提供) ;石蜡切片机 (德国徕卡RM2245) 。MMP2、MMP3和TIMP1鼠抗兔多克隆抗体 (Orb gen公司, AOK12761-1) , 生物素-链霉卵白素兔免疫组化试剂盒 (北京中衫金桥公司, 生成批号:K142415E) , 寡核苷酸引物oligo、逆转录酶RTase、4%多聚甲醛固定液、青霉素钠粉针剂 (80万U/支) (银川市伟博鑫生物科技有限公司) 。烙灸所用艾绒 (宁夏医药公司) 。
2 实验方法
2.1 模型制备
使用Hulth法制备KOA模型[12]。实验动物适应性饲养5天后, 模型对照组和烙灸干预组的所有动物进行KOA造模。3%苯巴比妥钠溶液 (1 m L/kg) 兔耳缘静脉注射, 麻醉满意状态下将实验兔左后肢膝关节固定, 做好局部脱毛、备皮、消毒工作, 沿兔膝关节内侧纵向切开皮肤4 cm, 暴露关节腔, 探査关节腔内有无原发病灶, 切除内侧半月板, 切断前交叉韧带, 动作轻柔谨慎不伤及关节软骨。止血, 生理盐水冲洗关节腔后缝合关节囊及皮肤切口, 最后碘伏棉球擦洗局部伤口, 包扎敷贴, 每只造模兔单笼内自由活动。为预防伤口感染术后常规肌注青霉素钠40万U/只, 连续3天;术后1周, 每天驱赶强迫造模兔笼内跑动15 min, 2次/天, 4周后可获得稳定的KOA模型[13]。
2.2 治疗方法
造模4周后开始干预, 烙灸干预组实验兔固定在兔台上, 左膝关节局部剃毛并脱毛, 将烙灸灸具放置在关节局部[14], 点燃灸槽内艾绒3 g, 烙灸灸具直接接触兔左膝关节局部, 烙灸灸具可使兔左膝关节局部皮肤发红, 每天1次, 每次20 min, 治疗4周后进行取材。模型对照组不予烙灸干预治疗, 只进行兔台固定步骤, 20 min/天, 4周后取材。空白对照组同样4周后取材, 不予任何干预措施。
2.3 软骨取材及SP免疫组化方法检测
采取空气栓塞法处死所有试验动物, 立即切开左膝关节腔, 迅速切取、剥离胫骨平台和股骨内侧髁的软骨, 一分为二:取一份立即放入液氮保存备用;第二份冰上切成约0.5 cm×0.5 cm×0.5 cm大小组织块, 4%多聚甲醛液固定、10%乙烯二胺四乙酸脱钙, 常规脱水、透明、浸蜡、包埋、切片, 一份进行常规HE染色, 其余采用SP免疫组化方法检测MMP2、MMP3和TIMP-1的表达。SP免疫组化切片采用Image-ProP-lus 5.1图像分析系统分析, 随机选取5个视野计算其平均值, 灰度值反映阳性表达率。
2.4 免疫印迹 (Western blot, WB) 法检测MMP2、MMP3和TIMP-1蛋白表达
取液氮保存的软骨约50 mg, 研磨至粉末状, 细胞裂解法提取软骨总蛋白并测浓度, SDS-Page凝胶电泳, 剥胶, 转膜, 分别加入MMP2、MMP3和TIMP-1 (1∶500) 一抗, 二抗IgG孵育。逐一显影、定影、洗片、凝胶、成像, 采用Image too 3.0影像软件分析, 参照β-actin条带灰度值分析目标蛋白条带相对应灰度值。
2.5 半定量RT-PCR检测
取液氮保存的软骨约10 mg置于Trizol液匀浆, 氯仿混匀, 离心后取上清加入等体积异丙醇, 再离心, 弃上清, 完成总RNA提取;分离总RNA之后, 经DEPC处理的双蒸水稀释, 分光光度仪测定含量, 分装, -80℃保存备用。以GAPDH作为内参照, 用半定量RT-PCR检测各组MMP2、MMP3和TIMP-1 mRNA表达水平。 (1) 反转录反应:总RNA样品2μL, 加上MD (寡核苷酸引物) , 经AMV (家禽成髓细胞性白血病病毒) 逆转录酶作用下进行逆转录合成cDNA。 (2) PCR扩增:扩增条带, 95℃, 5 min;95℃变性, 1 min后65℃退火, 30 s;72℃延伸, 60 s, 上述条件下进行40个循环扩增。各组引物序列按基因库设计并合成如下:MMP2上游5'-GTGGATGATGCCTTTGCTCG-3', 下游5'-AGTCCGTCCTTACCGTCAAA-3', 152 bp;MMP3上游5'-CAAGTCCCTCAGGATTCTCGAAC-3', 下游5'-GGTGTGGATGCTTCTTGGGTAA-3', 187 bp;TIMP1上游5'-ATGGCGCCC-TTTGCATCTCT-3', 下游5'-TCAGGCTTCAGCTTTTGCCA-3', 654 bp;GAPDH上游5'-ATGGCCTTCCGTGTTCCTAC-3', 下游5'-TTACTCCTTGGAGGCCATG-T-3', 317 bp。相应的扩增产物经琼脂凝胶电泳后于成像系统摄片, 光密度扫描, 相对量分析时以GAPDH作校正。
2.6 观察指标
(1) SP免疫组化观察MMP2、MMP3和TIMP-1表达; (2) Western blot检测软骨细胞外基质MMP2、MMP3和TIMP-1蛋白水平; (3) 半定量RT-PCR检测软骨细胞外基质MMP2、MMP3和TIMP-1的mRNA表达。
2.7 统计方法
所得数据采用SPSS 18.0软件分析。计量资料用均数±标准差 表示, 多组间比较采用One-Way ANOVA分析。以P<0.05为具有显著统计学差异。
3 结果
3.1 3组SP免疫组化检测结果比较
MMP2、MMP3和TIMP-1在软骨细胞外基质的阳性表达呈黄色或棕黄色颗粒, 均分布于细胞质。烙灸干预组软骨细胞外基质中MMP2、MMP3的表达增多, 高于空白对照组, 但明显低于模型对照组 (P<0.05) ;烙灸干预组软骨细胞外基质中的TIMP-1的表达减少, 低于空白对照组, 但明显高于模型对照组 (P<0.05) 。见表1、图1。
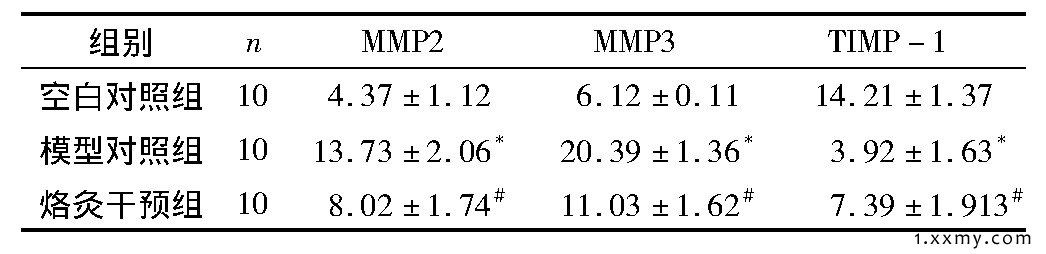
表1 3组软骨细胞外基质中MMP2、MMP3和TIMP-1灰度值比较
注:与空白对照组比较, *P<0.01;与模型对照比较, #P<0.05。
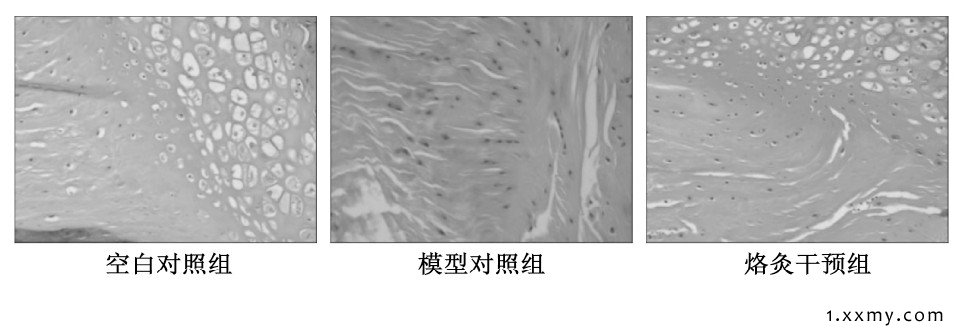
图1 3组实验兔软骨组织病理切片图 (100×)
3.2 3组Western blot检测结果比较
烙灸干预组软骨细胞外基质中的MMP2、MMP3蛋白表达量增多, 高于空白对照组, 相对于模型对照组明显减低 (P<0.05) ;烙灸干预组软骨细胞外基质中的TIMP-1蛋白表达较模型对照组明显增高 (P<0.05) 。见图2、3。
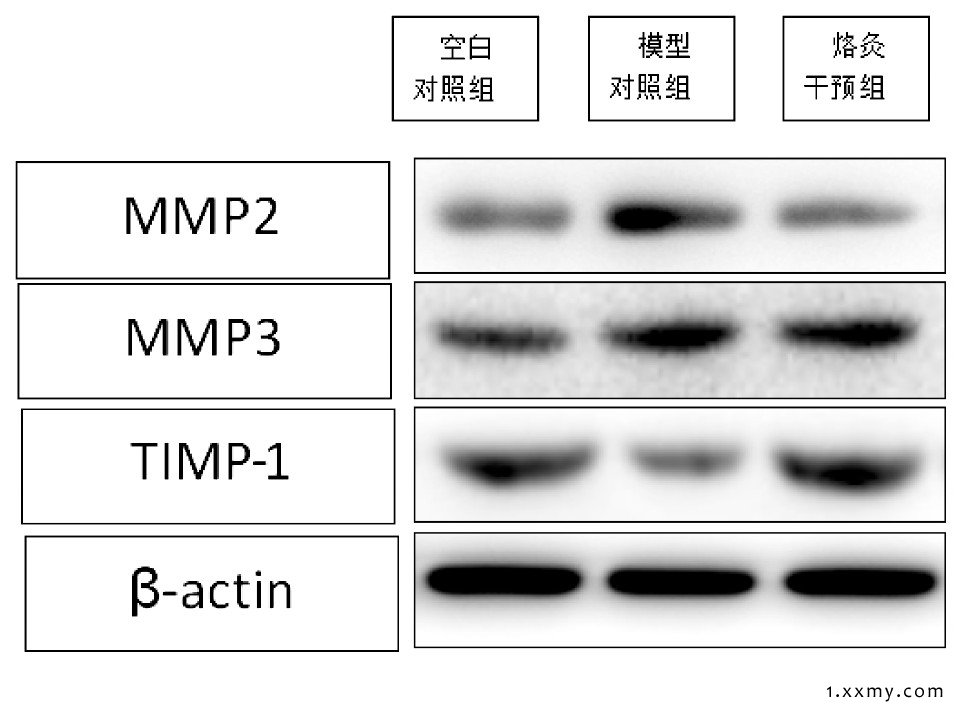
图2 3组软骨细胞外基质MMP2、MMP3和TIMP-1蛋白相对表达水平
图3 3组软骨细胞外基质MMP2、MMP3和TIMP-1蛋白相对表达量
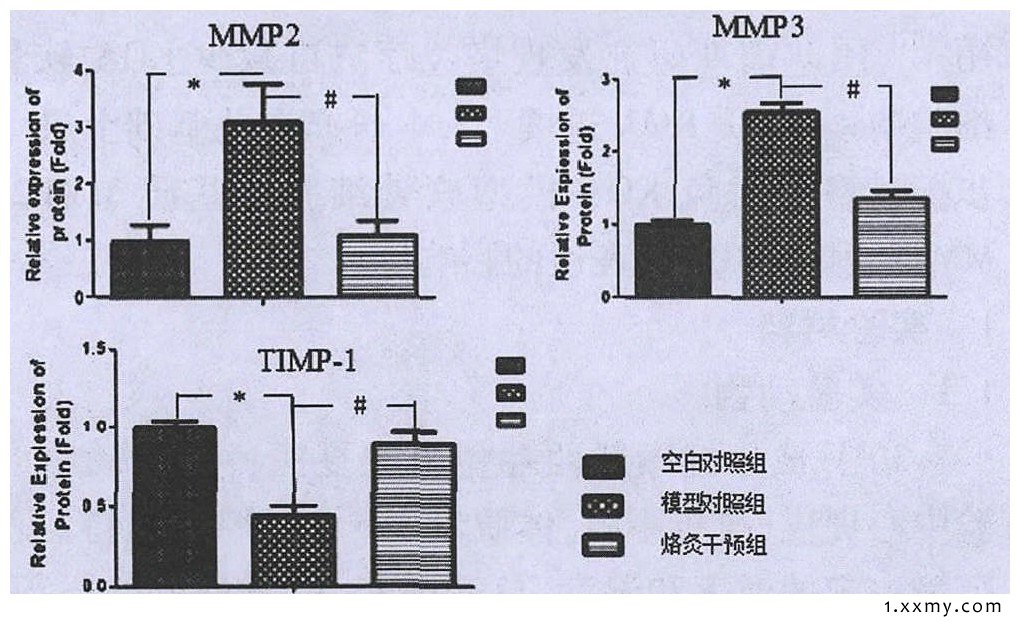
注:与空白对照组相比, *P<0.01;与模型对照组相比, #P<0.05。
3.3 3组RT-PCR检测结果比较
烙灸干预组软骨细胞外基质中的MMP2、MMP3mRNA表达量增多, 高于空白对照组, 相对于模型对照组明显降低 (P<0.05) ;烙灸干预组软骨细胞外基质中的TIMP-1 mRNA表达较模型对照组明显增高 (P<0.05) 。见图4。
4 讨论
膝骨性关节炎在传统医学中属“痹证”范畴, 属于“骨痹”, 发病主要与风寒湿邪、劳损、气血不足、肝肾亏虚等因素相关[15], 与现代医学的流行病学因素相符合;病机为风寒湿侵入机体, 痹阻关节筋络, 导致肾虚骨痹, 其治则为驱邪扶正, 驱除风寒湿瘀之邪, 温肾壮骨以扶正。依据《回回药方·针灸门》“是凡一体内, 多有恶润凝聚以致本体, ……必以火灸之, 则本体病根尽去”[16]中所阐述的回医烙灸疗法, 是中医化脓灸的发展与深化, 具有刺激面积大、施灸量可控及铁制灸具传递热量迅速和均匀等优点, 具有浓郁的民族特色。通过局部的温热作用祛除“骨痹”局部污血、恶润、凝聚等病理产物, 是具有地方民族特色的治疗方法, 起到“温肾散寒、强筋壮骨”的作用, 符合“膝痹”的传统医学治疗原则。
图4 半定量RT-PCR检测软骨外基质MMP2、MMP3和TIMP-1 mRNA的表达
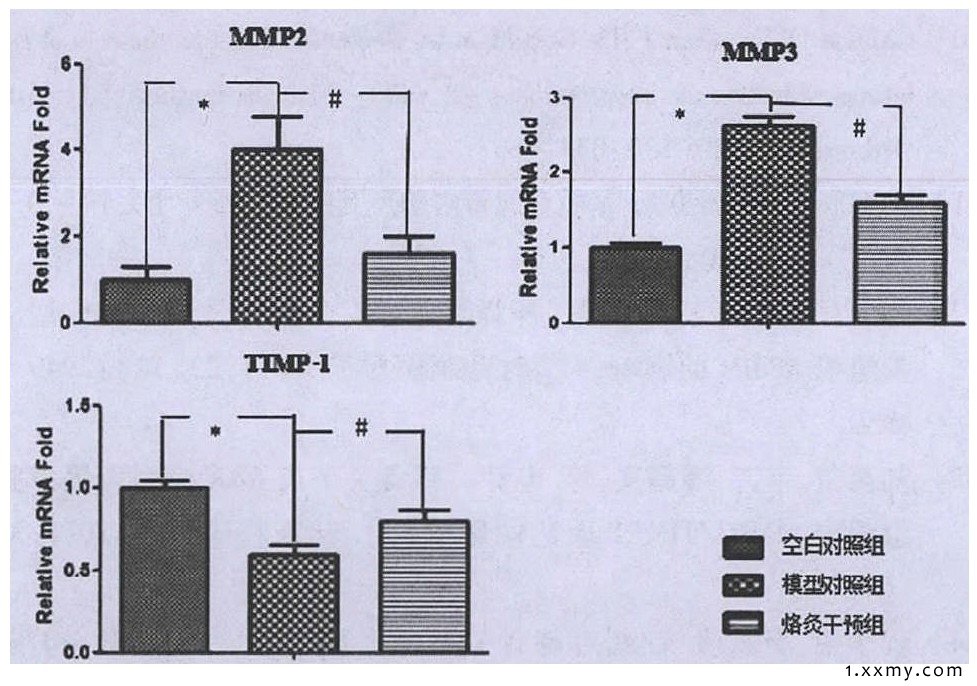
注:与空白对照组相比, *P<0.01;与模型对照组相比, #P<0.05。
软骨外基质的主要成分涉及胶原和蛋白聚糖, 而基质金属蛋白酶 (MMPs) 的主要作用是通过水解酶类作用对细胞基质分解代谢起催化作用, 过度降解ECM成分, 破坏关节软骨纤维和胶原网结构, 使弹性丧失, 对软骨保护作用降低, 加强软骨代谢, 最终导致关节炎[17];根据底物特异性和结构分为5种不同亚型, MMP2、MMP3分属明胶酶和间质溶酶素。MMP2属于明胶酶A, 可直接参与ECM的降解[18], 主要降解各型明胶、多糖、IV、V、VII、X型胶原等;MMP3可特异性降解蛋白多糖、层粘连蛋白及纤维粘连蛋白等, 属于间质溶素;在正常的ECM中也有表达, 但如果过度表达时, 可激活MMPs的其他亚型, 加速胶原的病理降解[19]。金属蛋白酶抑制剂 (tissue inhibitor of matrix metalloproteinase, TIMPs) 属于MMPs生理性抑制剂, 其中, TIMP-1是TIMPs抑制MMPs活性最强的酶[20], 通过与MMPs不可逆的结合, 抑制MMPs对ECM的降解, 防止胶原、蛋白聚糖过度降解[21]。TIMPs与MMPs二者的平衡可以保持ECM合成和降解的平衡, 如果二者动态失衡将导致软骨ECM的过度降解而致软骨细胞过度凋亡, 促进关节炎的进展。
本实验通过烙灸治疗兔KOA模型, 观察到烙灸可以显著抑制兔膝关节软骨细胞外基质MMP2、MMP3的蛋白、mRNA表达, 而上调TIMP1的蛋白、mRNA表达, 究其原因, 可能与烙灸治疗过程中, 艾绒燃烧时发生热的传递与渗透, 热能到达病变局部, 调节了细胞外基质金属蛋白酶及其抑制剂的合成代谢, 有效降低细胞外基质的过度降解, 维护细胞外基质环境的稳定。同时, 前期研究发现烙灸可以减轻兔膝关节软骨细胞的凋亡[11], 结合本次实验发现烙灸可以改善细胞外基质的合成代谢, 验证了KOA发病发展过程中软骨细胞与细胞外基质二者可以相互影响的关系。
烙灸可以降低软骨细胞外基质MMP2、MMP3表达, 提高TIMP1的表达, 同样的结果在其他研究学者的实验上也得到证实, 阚卫兵等学者[22]应用基因芯片测定家兔KOA模型滑膜组织MMP2、MMP3, 发现二者表达均增高。另有学者研究发现, KOA软骨细胞MMP2、MMP3表达经针灸干预后显著下调, 而TIMP-1表达上调, 达到纠正二者失衡、抑制ECM的过度降解、保护关节软骨的作用[23,24,25]。综上所述, 烙灸疗法对膝骨性关节炎的保护可能是通过烙灸下调关节软骨细胞外基质的基质金属蛋白酶、上调其蛋白酶抑制剂而起作用。
来源:针灸临床杂志 作者:林瑞珠 陈美华 马川 王月 许建峰
|


